首款国产干细胞药品获批背后:市场规模超250亿元,将带来哪些新的治疗希望?
艾米迈托赛的获批标志着干细胞商业化元年的开启。
1月2日,国家药监局(NMPA)官网显示,铂生卓越生物科技(北京)有限公司(下称“铂生卓越”)的干细胞疗法艾米迈托赛(商品名:睿铂生)获批上市,用于治疗 14 岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD)。
这是中国首款干细胞治疗药品,艾米迈托赛的获批也标志着干细胞商业化元年的开启。
移植物抗宿主病是异基因造血干细胞移植后,受者在重建供者免疫的过程中,来源于供者的淋巴细胞攻击受者组织发生的一类多器官综合征,表现为主要累及皮肤、胃肠道、肝、肺和黏膜表面的组织炎症和/或纤维化,根据临床表现和发病时间分为急性、慢性和兼具有二者特征的重叠综合征。移植物抗宿主病是术后非复发性死亡的原因之一,目前其主要预防方案为钙调磷酸酶抑制剂加抗代谢药物,一线全身性治疗主要采用以糖皮质激素为基础的方案。
据央视新闻报道,艾米迈托赛注射液作为处方药上市,将在医院凭医生处方治疗相应疾病。1月3日,针对定价及上市销售问题,时代周报记者以患者家属名义联系铂生卓越,相关工作人员表示,目前,艾米迈托赛注射液的价格还未最终确定,商业流通方面公司也会布局,产品预计将在一个月内进驻北京人民医院、301医院等医疗机构。
 图片来源:图虫创意
图片来源:图虫创意
零的突破
时代周报记者综合了解到,干细胞是一类具有自我复制功能,可无限分化的细胞的统称,其按分化潜能可进一步细分为全能干细胞(如胚胎干细胞)、多能干细胞(如间充质干细胞等)和单能干细胞(如造血干细胞等)等。
其中,间充质干细胞(MSC)凭借低免疫原性和多向分化潜能成为中国干细胞研究的热门领域。据了解,间充质干细胞广泛存在于成人和胎儿的多个组织中,最常见的来源为骨髓、脂肪、脐带和脐带血。这些细胞冻存后易复苏和体外大量扩增,可批量生产用于临床疾病治疗。
根据Insight数据库,艾米迈托赛是一款间充质干细胞疗法,早在2013年3月就在国内递交了临床研究申请(IND),但直至2020年6月才首次公示临床试验。
艾米迈托赛的获批并非毫无征兆。时代周报记者注意到,2024年1月,国家药监局药品审评中心(CDE)正式发布《间充质干细胞防治移植物抗宿主病临床试验技术指导原则》,当时即有声音认为,国内首款干细胞药物的首个适应症可能是移植物抗宿主病。
2024年5月,铂生卓越获得全国第一张干细胞药品生产许可证。同时,国家药监局药品审评中心数据显示,艾米迈托赛于2024年6月27日获得NMPA新药上市申请正式受理并纳入优先审评品种。算下来,其仅用半年时间就成功获批,这样的获批速度也让业内忍不住惊叹。
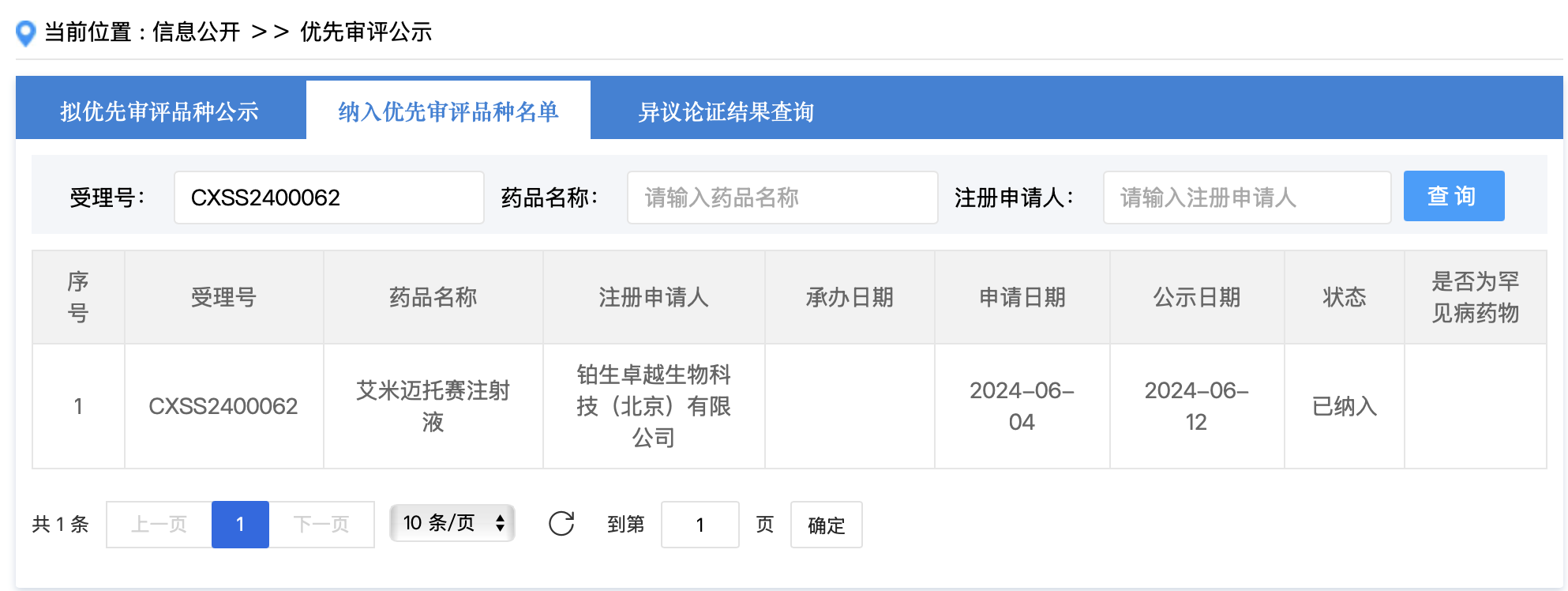 图源:CDE官网截图
图源:CDE官网截图
天眼查显示,铂生卓越成立于2010年,注册资本为5亿元,实缴资本为1.14亿元。目前,陈晓颖任公司董事长,陈文欣任公司副董事长、经理兼法定代表人。
实际上,早在美国食品药品监督管理局(FDA)批准首个间充质干细胞疗法时,业内便在期待首款国产间充质干细胞疗法的获批。2024年12月18日,美国FDA批准Mesoblast公司开发的Ryoncil(remestemcel)上市,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病。
艾米迈托赛与Ryoncil目前获批的适应症均为急性移植物抗宿主病,不过,两款药品适用的患者人群有所不同,前者适用于14岁以上人群,后者则用于2个月及以上儿童患者。此外,艾米迈托赛系人脐带间充质干细胞注射剂,而 Ryoncil则是同种异体骨髓生成的间充质基质细胞。
国内干细胞赛道升温
目前,国内根据干细胞产品上市目的和应用领域的不同,实施“双轨制”监管,即由国家卫健委负责的 “备案制”和由药监部门负责的“注册制”,以严格监管因干细胞产品特殊性而可能引发的伦理道德和安全性风险。根据国家医学研究登记备案平台的数据,截至2023年12月初,该平台有141家干细胞机构通过备案,合计通过127个干细胞研究备案项目。
时代周报记者注意到,过去一年,国内陆续推出了多项关于干细胞产业发展的相关政策。2024年3月,国家干细胞转化资源库正式颁布了《临床级细胞运输管理规范(试行)》,旨在规范并提升细胞治疗领域中细胞运输的管理水平。同年8月,国家科技管理信息系统公共服务平台发布通知,“干细胞研究与器官修复”被列为2024年度国家重点研发计划的重点专项之一;9月,商务部、国家卫健委与国家药监局三部门联合发布了《关于在医疗领域开展扩大开放试点工作的通知》,通知明确指出在北京、上海、广东三个自由贸易试验区以及海南自由贸易港内,外商投资企业将被允许涉足人体干细胞、基因诊断与治疗技术的深度开发与应用领域;11月,北京市医保局宣布扩大干细胞移植医保报销范围。
来自前瞻产业研究院的《2024中国干细胞行业市场研究报告》显示,2024年中国干细胞市场规模预计约为265亿元,其中干细胞采集、制备及存储领域市场规模接近160亿元。
广阔的市场前景亦吸引了诸多企业布局,国内干细胞赛道迎来快速发展。
民生证券发布的研究报告指出,从2020年我国干细胞创新药规范发展开始,国内干细胞IND数量几乎每年翻一倍,到目前国内干细胞IND数量已近百,且其中有多款干细胞创新药进入了临床II期、III期阶段,干细胞创新药在国内即将开始商业化浪潮。
1月2日,国家药监局药品审评中心副主任王涛在接受央视新闻采访时也透露,从2017年开始到现在,我国干细胞一共批准了120多款药品进入临床试验阶段,适应症包括血液系统、呼吸系统、心血管系统以及部分自身免疫系统疾病。
其中,由中源协和开发的MSC药品VUM02已取得国家药监局核准签发的8个临床试验批件,其中治疗失代偿期肝硬化获批Ib/II期临床试验;ST九芝(300989.SZ)的异体骨髓间充质干细胞治疗缺血性脑卒中适应症已进入临床IIa阶段;此外,泽辉生物开发的PSC(多能干细胞)来源细胞治疗产品ZH901也已进入II期临床。作为专注干细胞创新药的生物科技企业,泽辉生物正在冲刺上市,公司已于2024年9月在港交所披露招股说明书。
本网站上的内容(包括但不限于文字、图片及音视频),除转载外,均为时代在线版权所有,未经书面协议授权,禁止转载、链接、转贴或以其他 方式使用。违反上述声明者,本网将追究其相关法律责任。如其他媒体、网站或个人转载使用,请联系本网站丁先生:news@time-weekly.com







